撰写:学术矿姐
2022年,国自然基金委批准了一项重点项目“基于DNA水凝胶空间特征化骨类器官构建及其再生修复研究”(资助金额261万),探索将类器官技术应用于骨折、类风湿性关节炎、强直性脊柱炎等疾病的治疗。
近期,更是有两篇有关类器官(organoids)的高分综述发表,一篇为发表在SignalTransductionandTargetedTherapy(IF=38+)题为“Humanorganoidsinbasicresearchandclinicalapplications”的综述文章,另外1篇为发表在NatureMaterials(IF47+)上的题为“Next-generationcancerorganoids”,足见类器官是生物医学领域的研究热点。那么,类器官是什么?发展史如何?优势及应用?肿瘤类器官又是什么?类器官的挑战是什么?

类器官定义及发展史
类器官(Organoids),是指由来自健康个体或患者的多能干细胞(humanpluripotentstemcells,hPSCs)或成体干细胞(adultstemcells,AdSCs)进行体外三维(3D)培养的微型结构,概括了人体器官的细胞异质性、结构和功能,但并不是真的人体器官。类器官在基础生物学、疾病建模、治疗筛选、再生医学等方面具有潜在应用价值,但仍有尚待克服的现有限制或挑战。
类器官出现的锲机及发展史
在过去的100年里,二维(2D)细胞系和动物模型已经成功地应用于生物医学领域,可用于提高对细胞信号通路的认识,制定候选化合物设计指南,识别潜在的药物靶点,并阐明疾病的潜在病理机制。在当今世界生物医学研究中,这些系统的广泛使用是模型系统的价值体现。
然而,2D细胞系因其缺乏层次结构、维度、细胞多样性和细胞-细胞或细胞-基质相互作用,导致难以模拟组织中存在的细胞功能。动物模型因动物与人类之间的物种差异而不利于药物发现。组织外植体,虽可短暂地捕获生理相关的细胞组织和相互作用,但由于表型的快速消失,而很难在体外长时间维持。再者,了解人类遗传多样性,了解其对疾病病原和药物反应的影响,对于实现个性化医疗至关重要。因此,需要优化模型系统,以更好地模拟体内环境。
人类多能干细胞(humanpluripotentstemcell,PSC)技术和成体干细胞(adultstemcell,AdSC;也称为组织干细胞)培养系统的出现为建立体外人类特异性模型以用于研究与人类疾病相关的遗传变异以及在大规模化合物筛选中生成细胞材料开辟了道路。
1998年,人类胚胎干细胞(ESCs)系建立,是第一个人类多能干细胞系。
2006年,通过插入编码基因Oct4、Sox2、Klf4和c-Myc的转录因子,对小鼠成纤维细胞进行了重新编程,使其成为PSCs。这些细胞在基因表达和发育成三胚层的潜力方面与ESCs相似,被称为诱导PSCs(iPSCs)。
2007年,首次建立人类iPSCs(hiPSCs)技术,并广泛用于生成人类“disease-in-a-dish”模型。这项技术可以实现个性化的疾病建模,这将成为精准医学的重要组成部分。
随后,CRISPR/Cas9技术使得基于基因编辑的hiPSC疾病模型的创建成为可能。
1946年,“类器官”在肿瘤学中首次作为“畸胎瘤”的同义词被报道。在1960s代,“类器官”被用来描述发育生物学家进行的细胞分离和重新聚集实验中的器官发生。先前的研究利用了原代组织的3D自组织能力。
2009年,建立的肠道类器官培养系统引发了干细胞领域类器官系统的改进。该系统可以通过提供体内肠干细胞生态位成分(包括表皮生长因子EGF、Noggin和R-spondin-1)来维持分选Lgr5+干细胞或解剖隐窝的上皮样细胞的长期培养,并嵌入基质胶中以促进扩张,这些类器官在很大程度上复制了体内的组织结构,并含有相对完整的干细胞、祖细胞和终末分化细胞类型。通过修改生长因子和细胞分离程序的组合,研究人员可以快速改变3D培养系统,以生成多种人类正常和癌性类器官,如大脑、结肠、胃、和肝脏类器官。这种肠类器官体系的成功建立开启了类器官研究的新篇章,迅速成为新的研究热点。
随后,科学家们从小鼠和人的组织中培育出多种类器官。
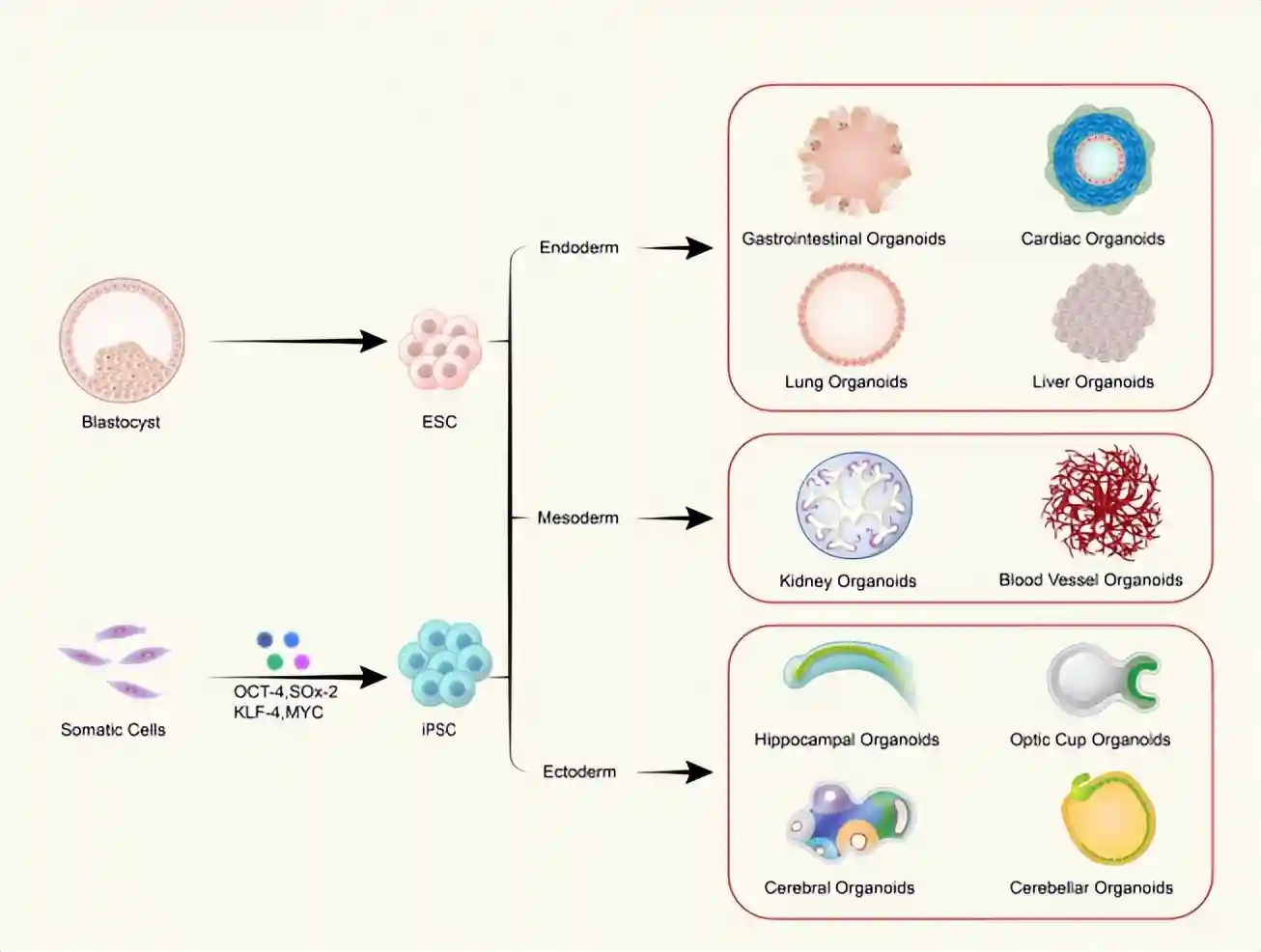
从多能干细胞(PSC)衍生的不同类器官的示意图
胚胎干细胞(ESC)和诱导多能干细胞(iPSC)被探索用于研究用途。通过引入四种转录因子,体细胞(Somaticcells)可以被重新编程为iPSC。随着发育的进行,囊胚分化为胚胎干细胞,并进一步形成所有三个胚层:内胚层、中胚层和外胚层。胚胎内胚层(oderm)随后产生胃肠系统、心脏、肺和肝脏。中胚层(mesoderm)发育成肾脏和血管系统,而外胚层(ectoderm)形成神经外胚层,最终形成具有不同区域的大脑,包括海马(hippocampus)、视杯(opticcup)、小脑(cerebellum)等。
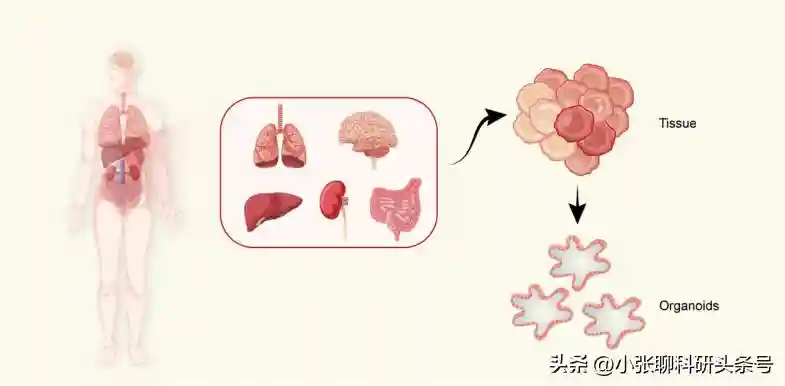
从器官中衍生出类器官,描述干细胞(stemcell,SC)衍生的类器官
这些类器官可以从器官中产生。与胚胎干细胞(ESC)不同,成体干细胞(AdSCs)是位于成人器官中的未分化细胞,如肺、脑、肝、肠和肾。用适当的培养条件处理后,AdSC能够在体外形成类器官。
近几十年来,研究人员已经成功地生成了各种类型的模拟体内器官的类器官。对于脑、视网膜、肾、肝、肺、胃肠、心脏、血管化和多谱系类器官体外分化技术的最新进展,以及PSC和AdSC-derived衍生类器官的区别的具体描述,见原文:;7(1):168.doi:10.1038/:35610212;PMCID:PMC9127490.这里,我们着重看下癌症类器官。
癌症类器官
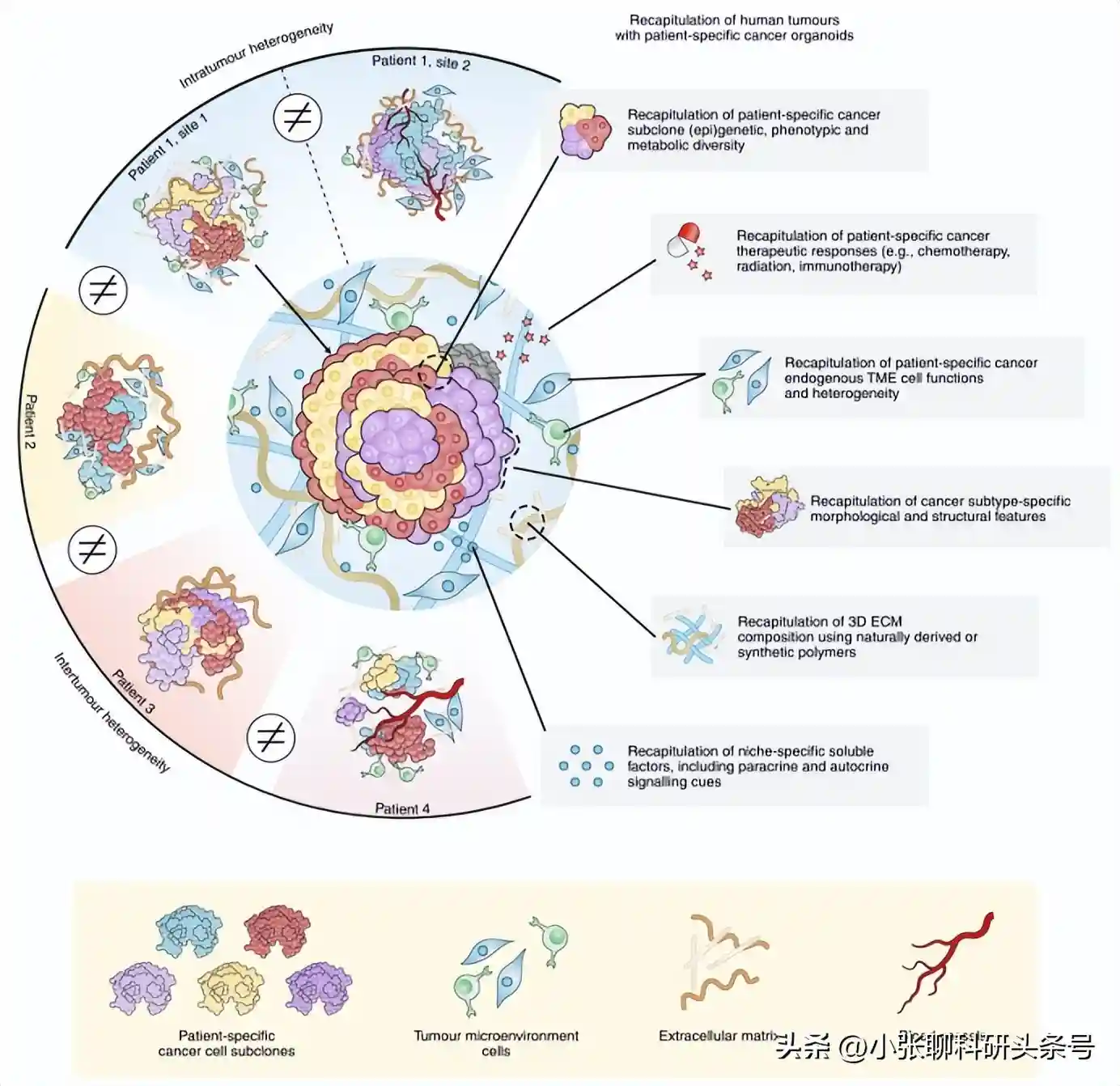
癌症类器官可代表患者特异性肿瘤异质性特征
体外类器官技术的应用
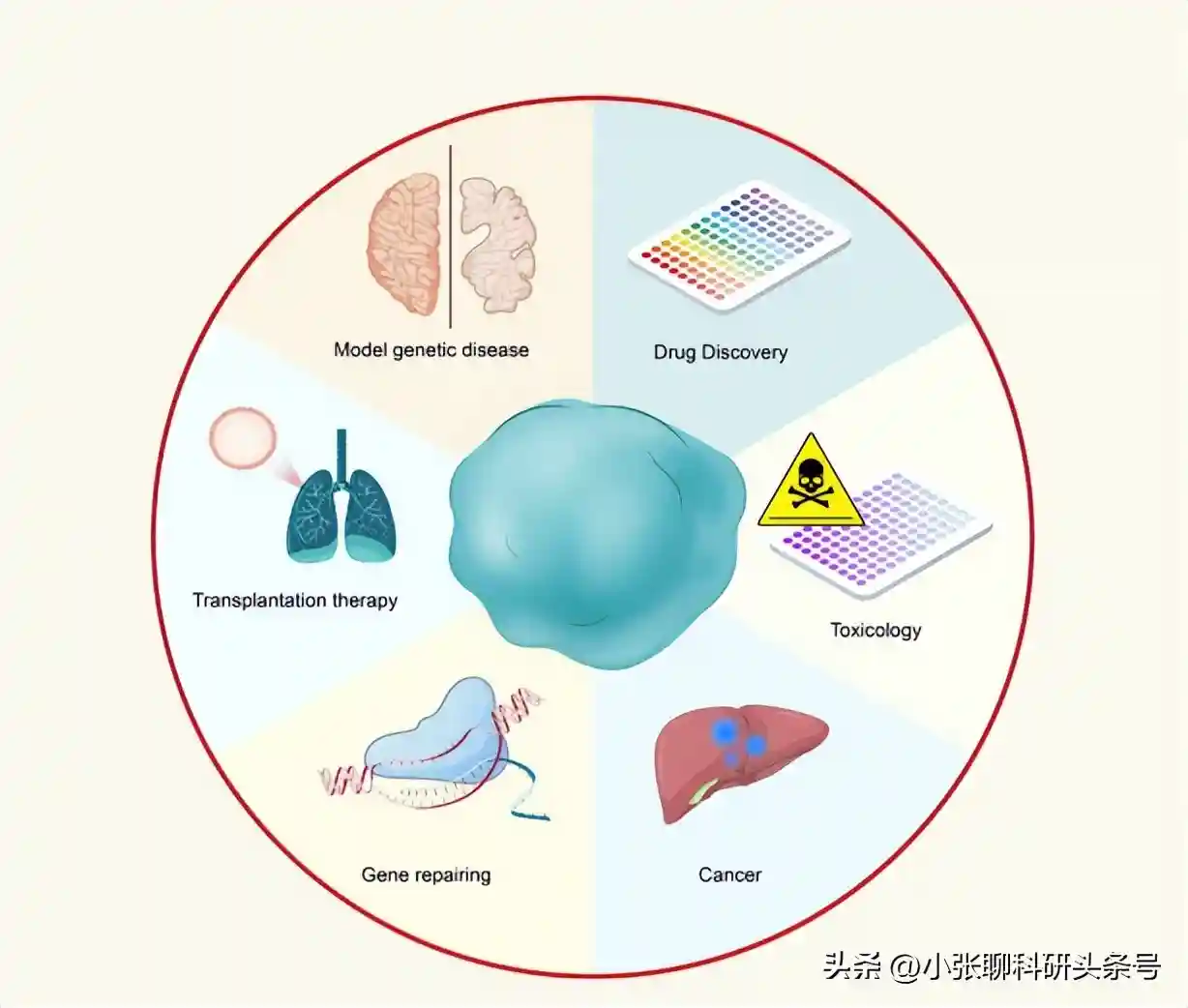
类器官技术的各种应用
类器官技术的挑战与展望
尽管3D类器官领域正在向前发展,并为生物医学研究和临床转化研究提供了创新方法,但仍有几个障碍需要解决。
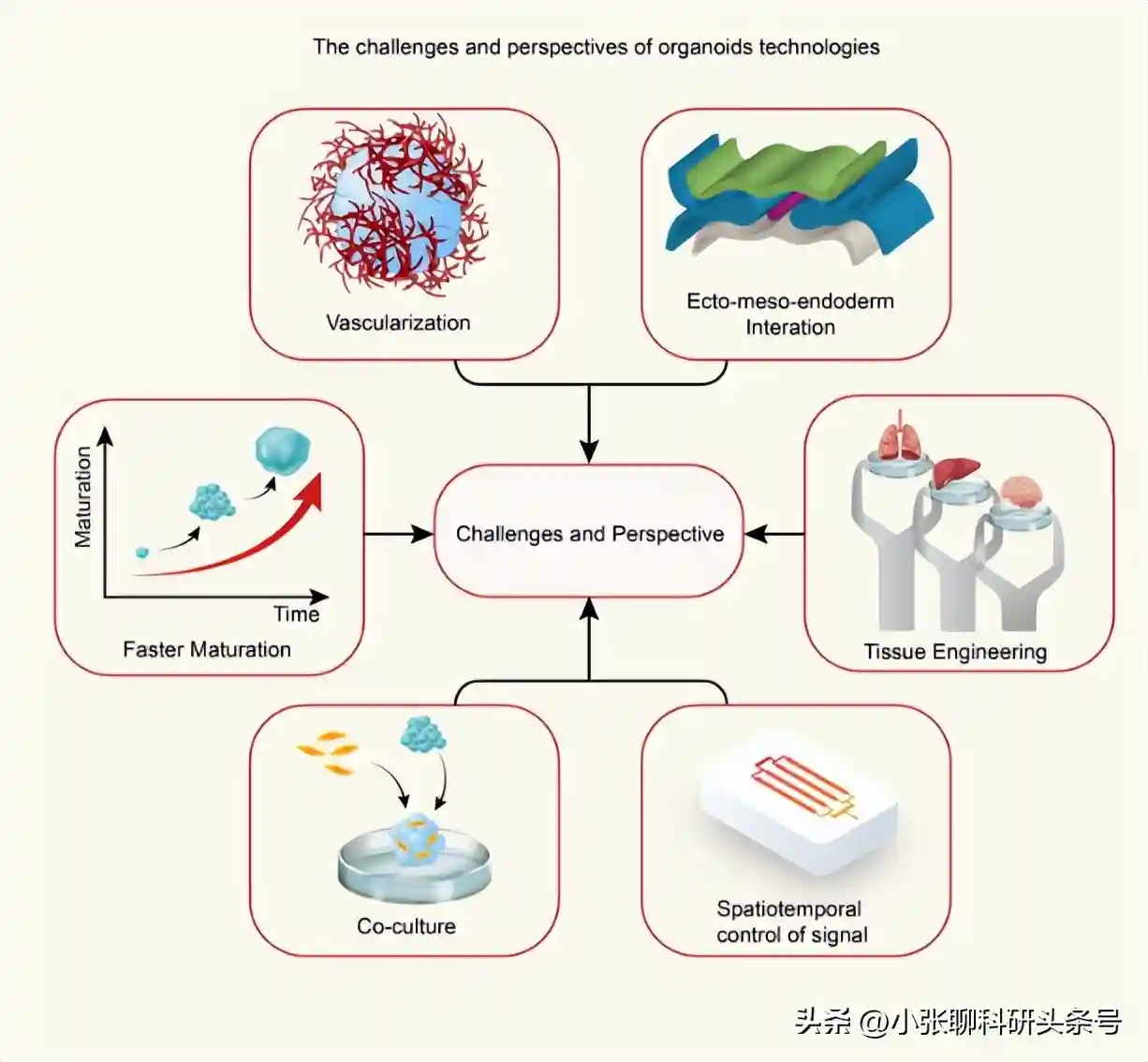
类器官技术的挑战与展望
首先,人类类器官培养依赖于小鼠衍生的ECM替代品,如基质胶和基底膜提取物。由于批量生产,这些提取物显示出组分的可变性,这影响了生物研究中实验结果的可复制性。此外,由于其未知的病原体及其引发的潜在免疫反应,它们可能阻碍直接临床移植。这一缺点可以通过临床级胶原培养来解决。生物工程策略也将为改进方法提供新的方向。
限制当前类器官培养方法在未来再生医学应用中使用的另一个因素是这些方法无法模拟多器官病理。共培养方法可以部分解决这一问题。据报道,最近的一项相关尝试涉及hPSC衍生的肠道类器官和神经嵴细胞的组合。此外,最近的研究还设计了创建器官芯片技术的策略,以生成3D系统,实现多个预制“器官”之间的连接和通信。
组织成熟是限制类器官技术充分发挥临床前甚至临床应用潜力的第三个关键因素。例如,类器官培养系统在很大程度上复制了胎儿大脑发育阶段,这使得难以对影响成人大脑的神经系统疾病进行建模,例如阿尔茨海默病。为了克服这些障碍,已经优化了许多方案,包括用小分子化合物(如BDNF261)预处理类器官,以加速成熟。氧合和营养扩散是成熟过程中的另外两个关键因素。类器官的长期培养不会随着时间的推移而扩大,而是由于缺氧导致类器官的核心立即发生凋亡/坏死,形成空腔。这在大脑类器官培养系统中相对频繁地观察到。为了解决这个问题,类器官最初是在旋转生物反应器中或使用摇床生长的。其他的尝试是设计各种的血管化技术策略。例如,全脑类器官已重新嵌入含有iPSC衍生内皮细胞的基质凝胶中,以形成血管化的类器官,这进一步促进类器官的生长并提供营养;此外,生物材料、纳米技术、生物工程和其他先进方案的结合可能会使人类类器官在未来得以扩大和长期培养。
另一个令人困惑的问题是,有限的再现性是产生更高级别类器官和控制其功能的主要障碍。影响类器官再现性的基本因素基本上包括批间变异、类器官生产可扩展性、细胞组成和类器官结构。Krefft及其团队已经建立了一种前脑类器官方法,该方法通过基于iPSC的自组织能力添加模式因子来减少异质性。为了应对这些挑战,可以预见的是,一个相对准确、可复制的3D模型可能会出现,实现类器官技术从科学研究到临床实践的转变,并加速更大规模的类器官制造用于药物筛选。
值得注意的是,与PSC衍生类器官不同,AdSC衍生类器官仅代表器官的上皮部分,因此总结了原始上皮的典型结构和功能;相比之下,基质、神经、免疫细胞和脉管系统的隔室是缺失的。因此,ASC衍生的类器官显示出比PSC衍生的器官更低的结构复杂性,但更接近成人组织。
总体而言,新兴的类器官技术已经对生物医学研究、个体化医学中的药物筛选以及与基因组编辑技术相结合的基因治疗有用。类器官的广泛应用尚处于探索的初期阶段。广泛的研究将使3D类器官系统能够补充现有的模型系统,这将在未来加强基础和临床研究。