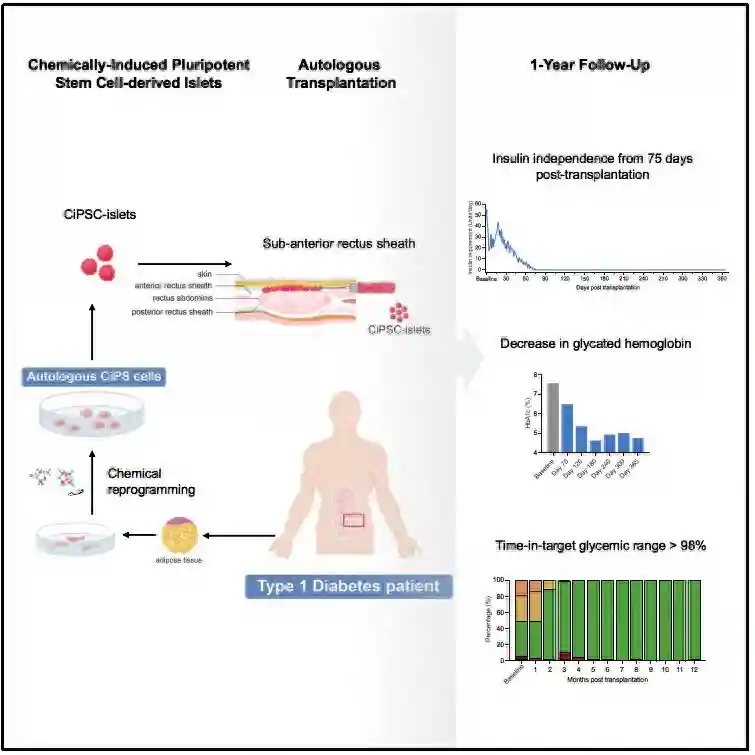
近日,中国科学院上海硅酸盐研究所吴成铁研究员带领的研究团队在免疫多细胞支架用于肌腱-骨修复领域取得重要进展。该团队通过多细胞打印技术将硅酸锰(MS)纳米颗粒与肌腱/骨相关细胞相结合,设计并构建了具有免疫调控功能的多细胞支架,用于肌腱和骨的一体化再生(如图1)。该免疫调节支架不仅在体外展现出多样性的生物活性,而且在多种肩袖损伤(RCT)动物模型中实现了免疫调节、多组织一体化再生和运动功能恢复。
肌腱-骨界面的独特结构可有效缓解应力集中,在人体运动功能中发挥着重要作用。当发生损伤时,由于生理结构复杂和再生能力差,临床手术治疗往往会导致界面处瘢痕组织形成,提高再次损伤几率。传统的生物材料倾向于增强与肌腱-骨直接相关的生物功能,如成骨分化或肌腱分化,但损伤部位三维微环境,尤其是体内免疫细胞引发的炎症反应,同样至关重要。根据研究经验,减少M1巨噬细胞在肌腱-骨界面的聚集并诱导M2巨噬细胞极化,可以获得更优的组织学和生物力学特性。但由于界面处的高负荷和高压力,巨噬细胞的M1和M2在肌腱-骨界面的转化存在延迟,能够导致慢性炎症。因此,开发出兼具多再生活性和免疫调节功能的组织工程支架对于肌腱-骨天然结构恢复至关重要。
研究团队结合多细胞3D打印技术与硅酸锰(MS)纳米颗粒,构建了免疫多细胞支架,其中肌腱干/祖细胞(TSPCs)和骨髓间充质干细胞(BMSCs)以分层方式分布在支架中,实现了肌腱-骨界面的模拟。得益于多细胞分布和MS纳米颗粒,免疫多细胞支架在体外同时展现了出色的成骨和成肌腱双向分化活性(图2)。此外,多细胞支架在兔和大鼠的RCT模型中同时实现了免疫调节、界面微结构再生和运动功能恢复(图3)。将免疫多细胞支架植入巨噬细胞耗竭的大鼠体内,进一步揭示了免疫调节在多细胞支架的特异性分化中的作用。此外,通过对其免疫生物学机制的探索,免疫多细胞支架能够稳定释放Mn离子刺激巨噬细胞分泌PGE2,从而增强多细胞的特异性分化(图4)。免疫多细胞支架的构建为软硬组织界面的一体化再生提供了一种前景广阔的新策略。
该研究成果近日发表在ScienceAdvances期刊上(ScienceAdvances,2024,10,eadk6610),文章题为“ImmunomodulatoryMulticellularScaffoldsforTon-to-BoneRegeneration”,并申请发明专利一项。论文第一作者为上海硅酸盐所硕士研究生杜琳和博士研究生吴金福,通讯作者为吴成铁研究员。

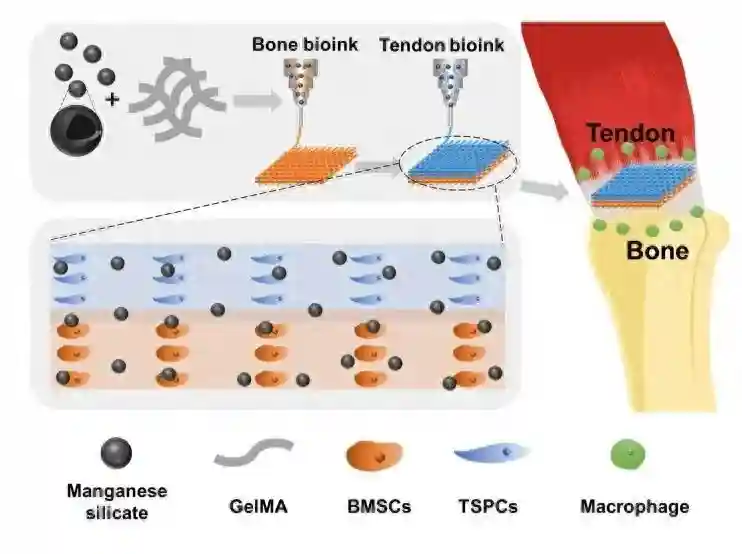
图1.基于硅酸锰(MS)纳米颗粒的免疫多细胞支架用于肌腱-骨一体化再生的示意图。
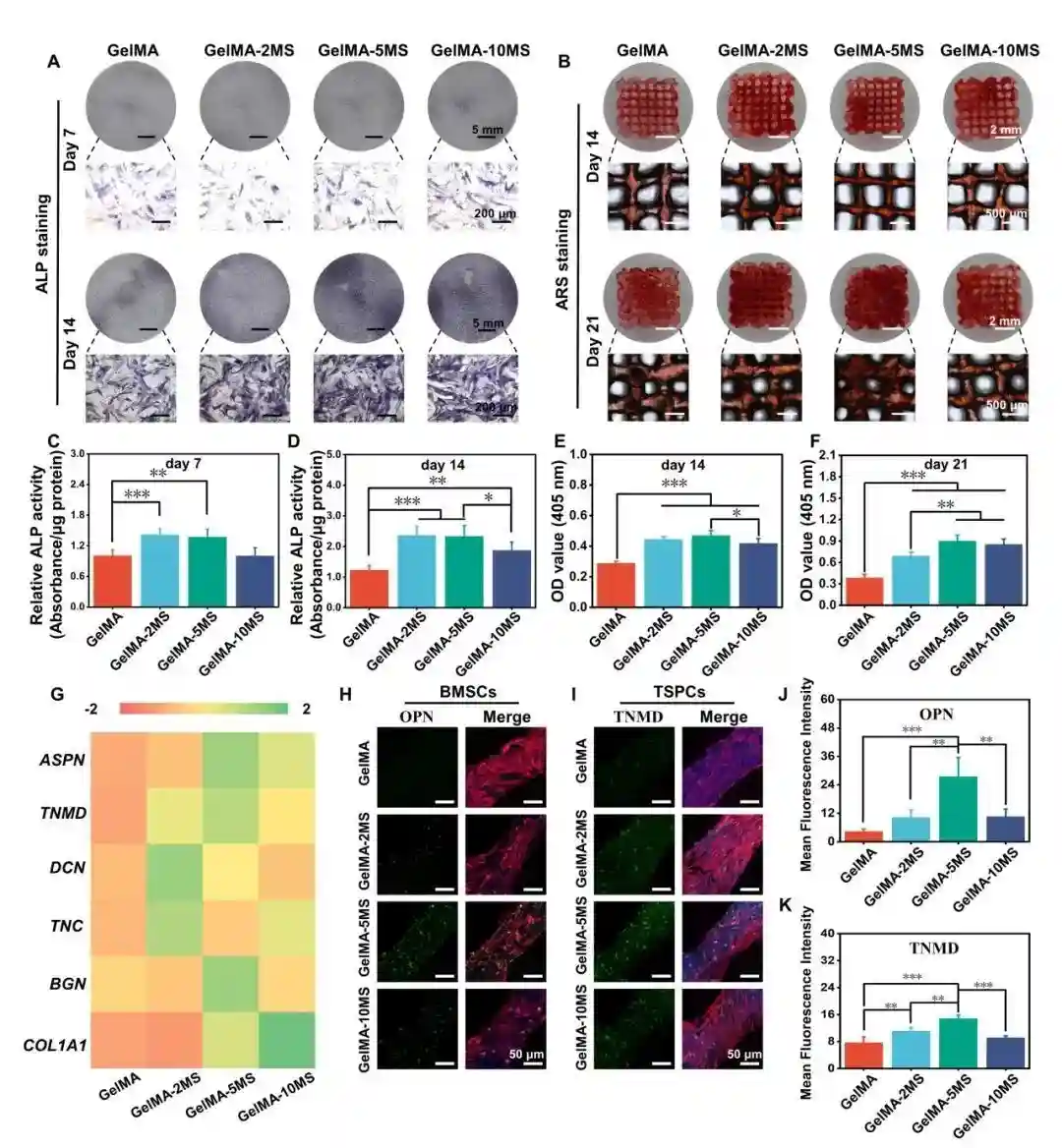
图2.免疫多细胞支架内BMSCs的成骨分化和TSPCs的成肌腱分化。含有不同浓度MS纳米颗粒的多细胞支架的(A)碱性磷酸酶(ALP)染色结果和(B)茜素红S(ARS)染色。(C)培养7天和(D)14天后ALP染色的半定量分析;(E)培养14天和(F)21天后ARS染色的半定量分析。(G)培养14天后含有不同浓度MS纳米颗粒的多细胞支架中TSPCs的成肌腱分化相关细胞因子的分泌情况。在含有不同浓度MS纳米颗粒的多细胞支架中,BMSCs中(H)OPN蛋白和TSPCs中(I)TNMD蛋白的表达情况。相应的(J)OPN和(K)TNMD蛋白表达的半定量分析。
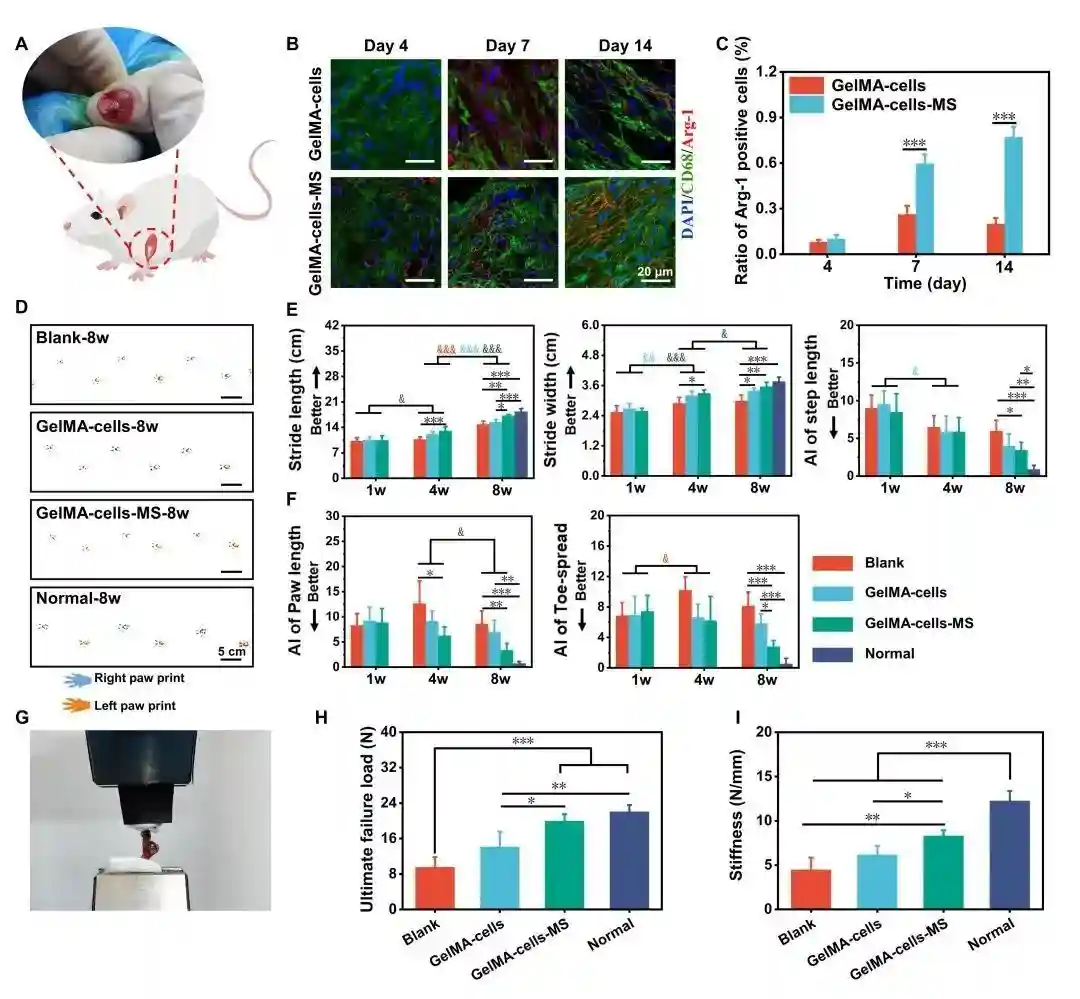
图3.基于MS纳米颗粒的免疫多细胞支架实现了对大鼠RCT的免疫调节和功能恢复。(A)大鼠RCT示意图。(B)植入支架周围巨噬细胞中M2极化相关标记物(Arg-1/CD68)的免疫荧光染色图像。(C)Arg-1阳性巨噬细胞与巨噬细胞总数的数量比。(D)不同组术后8周的爪印。不同组支架治疗的大鼠量化的(E)空间步态参数和(F)爪参数。(G)治疗后的大鼠的肩袖生物力学测试图像。不同支架治疗后肩袖的(H)最大破坏载荷和(I)韧性。
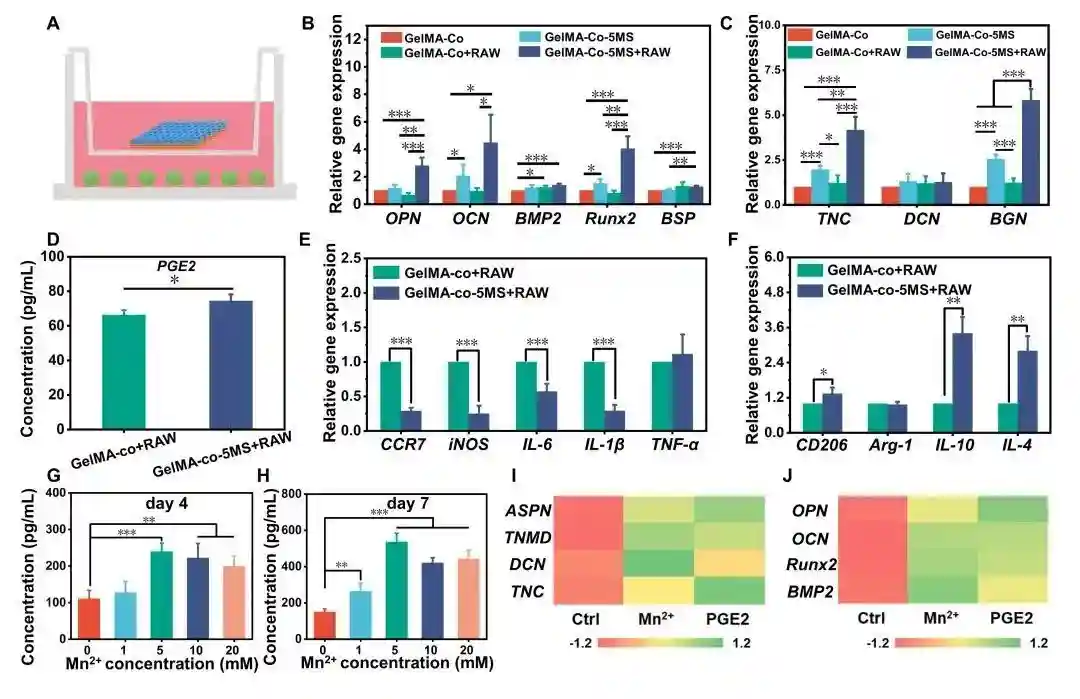
图4.基于MS纳米颗粒的免疫多细胞支架的免疫调节机制。(A)多细胞支架与细胞共培养示意图。(B)与细胞共培养7天后,多细胞支架中BMSCs的成骨分化相关基因表达情况;(C)TSPCs的成肌腱分化相关基因表达情况。(D)多细胞支架与细胞共培养第7天时培养液中的PGE2的浓度。(E)与多细胞支架共培养7天后细胞的促炎基因和(F)抗炎基因的表达。巨噬细胞在含Mn离子梯度浓度的培养基中培养4天(G)和7天(H)后的PGE2的表达。用Mn2+/巨噬细胞条件培养基或含PGE2培养基培养后,TSPCs(I)和BMSCs(J)成肌腱细胞因子和成骨细胞因子的分泌情况。